
みなさんは化学のモル計算は得意でしょうか?
化学基礎の中で最も厄介と言っても過言ではないモル。
難しいイメージのある単元ですが、実は算数の考え方を使うとモルの計算が解きやすくなります!
今回は、そんなモルの考え方をご紹介します。
化学のモルとは?基礎からおさらいしてみよう!
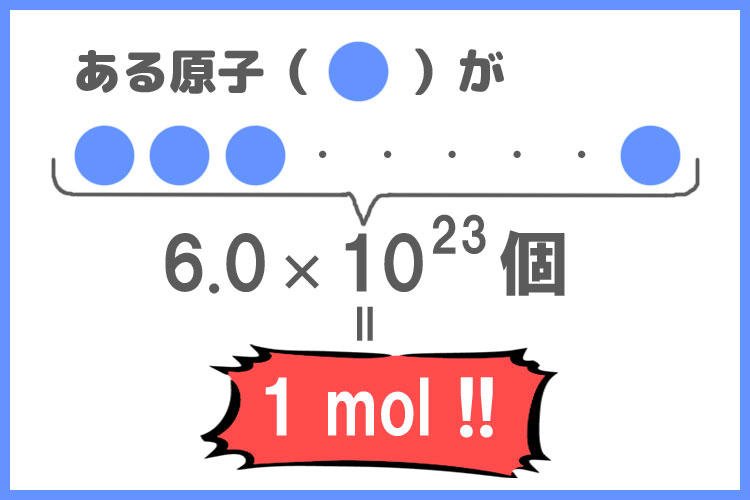
molは物質量の単位です。
ある原子が6.0×10の23乗個集まった時、「原子が1 mol存在する」と考えられます。
「原子が1molある」というのは、「原子が6.0×10^23個ある」ということです。
あくまでモルは物質の量を表すものだということを押さえておきましょう!
モルの計算が簡単になる!算数の考え方を使うコツとは?
まずは次の計算問題を解いてみてください。
例題
キッチンに20gの小麦粉があります。
クッキー1人分を作るのに必要な小麦粉は10gです。
キッチンにある小麦粉で何人分のクッキーが作れるでしょうか?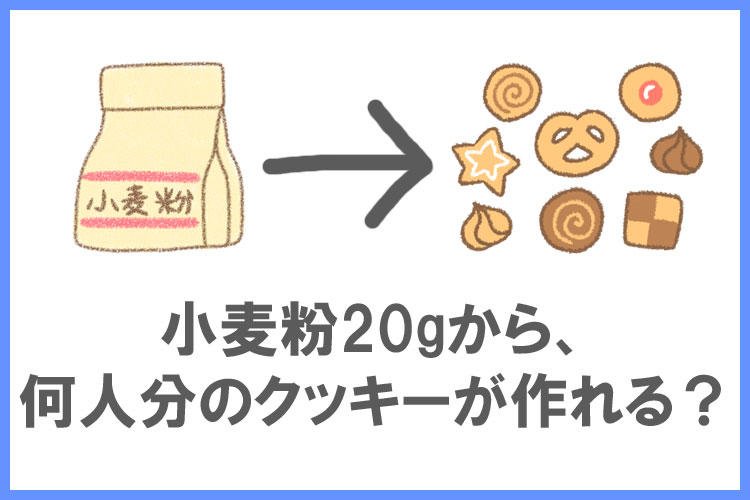
この問題の答えは「2人分」ですよね!
答えを出すことは簡単ですが、ここで答えを出すプロセスを考えてみましょう。
答えを瞬時に出せた人でも、次のように頭で考えたはずです。

この問題では、クッキー1人分にどれほどの小麦粉を使うかに注目して考えましたよね!
実は、モルの計算でもこの計算と同じように、「1molだとどれくらいの量なのか」に着目すると非常に解きやすくなるのです!
1モルとは?計算式が立てやすくなる方法まとめ
それでは、今の考え方をもとにモルの計算を解いてみましょう。
問題
水が36gあります。この水の物質量(mol)を求めなさい。
ただし、水の分子量は18とします。
ここで分子量という言葉が出てきましたが、難しく考える必要はありません。
「分子量にgをつけた値が1molの質量」と考えればOKです。
つまり、この問題は次のように言い換えられます。
水は1molあたり18gです。
36gの水の物質量(mol)を求めなさい。
ここで、先ほどのクッキーの考えを使って考えてみましょう!
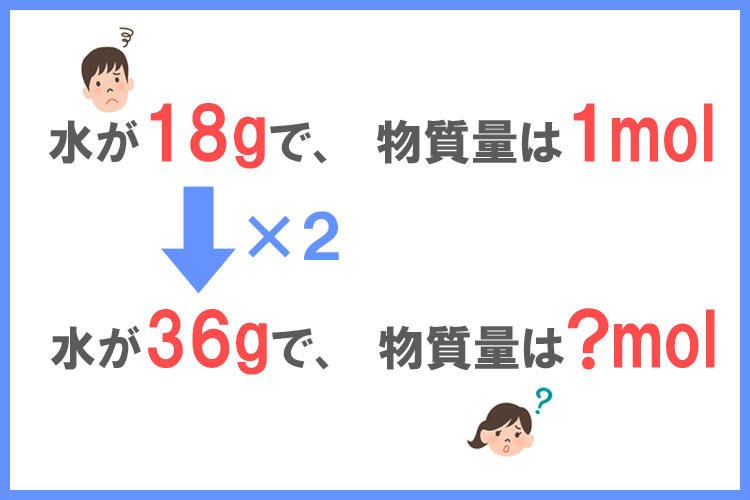
クッキーの計算と同じように考えると、水の質量が2倍に増えているので、36gの水の物質量は1molを2倍に増やした2molであることが分かりますね!
このように、モルの計算は、「1molでどれくらいの量なのか」に着目して考えると、どのような計算をしなくてはならないのかが考えやすくなります!
今回紹介した「1molあたりの量がどれくらいなのか」を考えながら問題を解くと、化学のモル計算で計算式を立てやすくなります!
みなさんも、モルの計算問題に取り組む際は、今回紹介した考えを思い出して、乗り切ってください!
<この記事を書いた人>
なっち先輩
なんだかとってもクッキーが食べたくなってきました(笑)
※この記事は公開日時点の情報に基づいて制作しております。先輩は卒業しています。








匿名
2024年10月 4日 14:04
全く分からんかった
このコメントに返信する >