- TOP
- 難関合格スタディ&ライフ
- 文系脳のキミでもわかる!化学のモル計算をどこよりも簡単に解説!
難関合格スタディ&ライフ
文系脳のキミでもわかる!化学のモル計算をどこよりも簡単に解説!
- 難関合格スタディ&ライフ
- 2025/02/27

みなさんは化学の「モル計算」は得意でしょうか?
難関大合格のためには、基礎を押さえることは欠かせませんが、化学基礎において、高校生の間でも特に難解という声が多いのが、モルの概念です。
ただ、難しいイメージのあるこの単元ですが、実は算数の考え方を用いるとモルの計算が格段に解きやすくなるのです!
そこで今回は、受験対策にも役立つモルの考え方をご紹介します。
化学のモルとは?基礎からおさらいしよう!
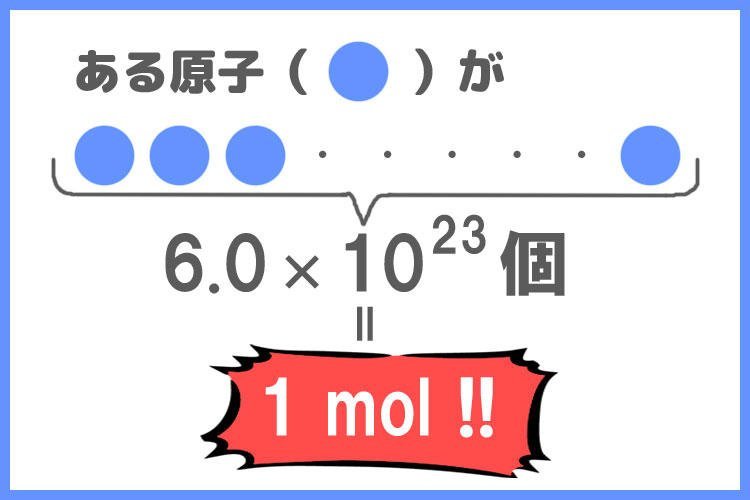
molは物質量を示す単位です。
ある物質がアボガドロ定数、すなわち6.0×10の23乗個の原子が集まった時、「原子が1 mol存在する」と考えられます。
「原子が1molある」というのは、「原子が6.0×10^23個ある」という定義なのです。
重要なのは、モルは物質の量を表すものであることを押さえておきましょう!
モルの計算が簡単になる!算数の考え方を使うコツとは?
まずは次の計算問題を解いてみてください。
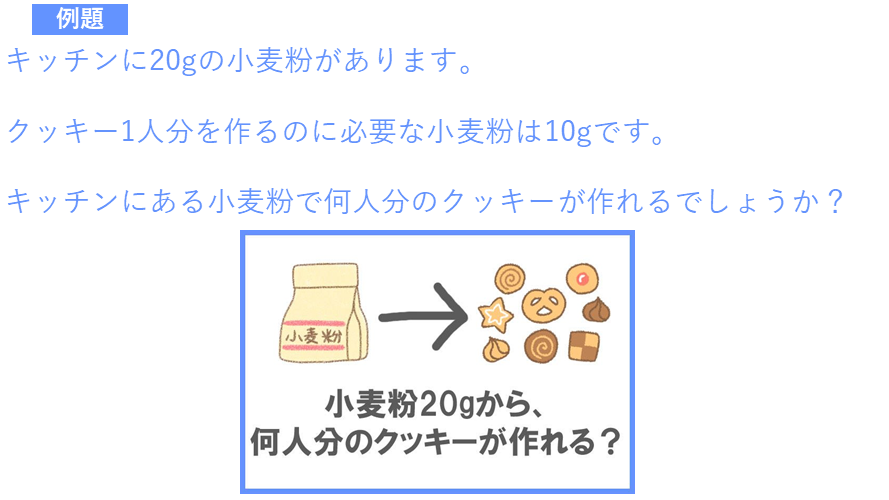
…この問題の答えは「2人分」ですよね!
答えを出すことは容易ですが、ここで答えを出すプロセスを考えてみましょう。
答えを瞬時に出せた人でも、次のように頭で考えたはずです。

この問題では、クッキー1人分にどれほどの小麦粉を使うかに注目して考えましたよね!
実は、モルの計算でもこの計算と同じように、「1molだとどれくらいの量なのか」に着目すると非常に解きやすくなるのです!
1モルとは?計算式が立てやすくなる方法まとめ
それでは、今の考え方をもとにモルの計算を解いてみましょう。

ここで分子量という言葉が出てきましたが、難しく考える必要はありません。
「分子量にgをつけた値が1molの質量」と考えればOKです。
つまり、この問題は次のように言い換えられます。
水は1molあたり18gです。
36gの水の物質量(mol)を求めなさい。
ここで、先ほどのクッキーの考えを使って考えてみましょう!
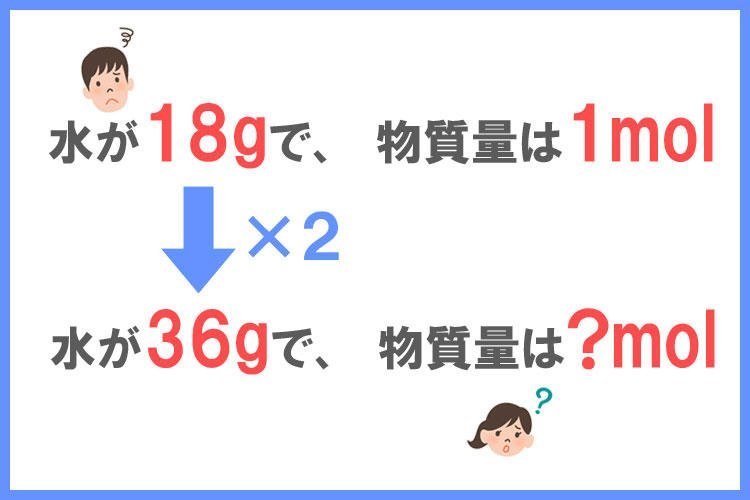
クッキーの計算と同じように考えると、水の質量が2倍に増えているので、36gの水の物質量は1molを2倍に増やした2molであることが分かりますね!
このように、モルの計算は、「1molでどれくらいの量なのか」に着目して考えると、どのような計算式を立てなくてはならないのかが考えやすくなります!
みなさんも、モルの計算問題に取り組む際は、今回紹介した考え方を思い出して、乗り切ってくださいね。ちなみに高校3年分の分野に対応した
では、化学のモルをはじめ、重要分野の対策を自分のペースでできるので、それらで理解を深めつつ、志望大合格に向かっていきましょう!



